Với giải Câu 7 trang 79 Hóa học lớp 10 Kết nối tri thức với cuộc sống chi tiết trong Bài 16: Ôn tập chương 4 giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập Hóa học 10. Mời các bạn đón xem:
Giải bài tập Hóa học lớp 10 Bài 16: Ôn tập chương 4
Câu 7 trang 79 Hóa học 10: Copper (II) sulfate được dùng để diệt tảo, rong rêu trong nước bể bơi; dùng để pha chế thuốc Bordaux ( trừ bệnh mốc sương trên cây cà chua, khoai tây; bệnh thối thân trên cây ăn quả, cây công nghiệp)…
Cu + O2 + H2SO4 → CuSO4 + H2O (1)
a) Lập phương trình hóa học của phản ứng (1) theo phương pháp thăng bằng electron, chỉ rõ chất oxi hóa, chất khử.
b) Copper (II) sulfate còn được điều chế bằng cách cho đồng phế liệu tác dụng với sulfuric acid đặc, nóng:
Cu + H2SO4 (đặc) CuSO4 + SO2 + H2O (2)
Trong hai cách trên, cách nào sử dụng ít sulfuric acid hơn, cách nào ít gây ô nhiễm môi trường hơn?
Phương pháp giải:
- Chất nhường electron là chất khử
- Chất nhận electron là chất oxi hóa
- Các bước lập phương trình hóa học:
Bước 1: Xác định số oxi hóa của nguyên tử bị thay đổi:
Bước 2: Biểu diễn quá trình oxi hóa – khử:
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa theo nguyên tắc: tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
Lời giải:
a)
Bước 1: Xác định số oxi hóa của nguyên tử bị thay đổi:
![]()
Cu: chất khử
O2: chất khử
Bước 2: Biểu diễn quá trình oxi hóa – khử:
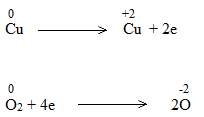
Bước 3: Tìm hệ số thích hợp cho chất khử và chất oxi hóa theo nguyên tắc: tổng số electron chất khử nhường bằng tổng số electron chất oxi hóa nhận.
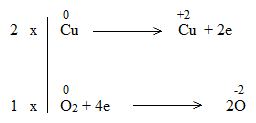
Bước 4: Đặt hệ số của chất oxi hóa và chất khử vào sơ đồ phản ứng từ đó tính ra hệ số của các chất khác có mặt trong phương trình hóa học. Kiểm tra sự cân bằng số nguyên tử của các nguyên tố ở hai vế.
2Cu + O2 + 2H2SO4 → 2CuSO4 + 2H2O
b)
Cách 1: 2Cu + O2 + 2H2SO4 → 2CuSO4 + 2H2O
Cứ 1 mol Cu cần dùng 1 mol H2SO4
Cách 2: Cu + 2H2SO4 (đặc) CuSO4 + SO2 + 2H2O
Cứ 1 mol Cu cần dùng 2 mol H2SO4
Theo tỉ lệ phản ứng, cách 1 sử dụng ít sulfuric acid hơn và ít gây ô nhiễm môi trường hơn. Do cách 2 sinh ra khí SO2.
Xem thêm các bài giải Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Câu 1 trang 78 Hóa học 10: Trong phản ứng oxi hóa – khử, chất oxi hóa là chất:...
Câu 2 trang 78 Hóa học 10: Trong phản ứng hóa học: Fe + H2SO4 → FeSO4 + H2, mỗi nguyên tử Fe đã...
Câu 3 trang 78 Hóa học 10: Trong phản ứng hóa học: 2Na + 2H2O → 2NaOH + H2, chất oxi hóa là...
Câu 4 trang 78 Hóa học 10: Cho nước Cl2 vào dung dịch NaBr xảy ra phản ứng hóa học:...
Câu 5 trang 79 Hóa học 10: Xét các phản ứng hóa học xảy ra trong các quá trình sau:...
Câu 6 trang 79 Hóa học 10: Xét phản ứng trong giai đoạn đầu của quá trình Ostwald:...
Xem thêm các bài giải SGK Hóa học lớp 10 Kết nối tri thức hay, chi tiết khác:
Bài 15: Phản ứng oxi hóa - khử
Bài 17: Biến thiên enthalpy trong các phản ứng hóa học